Thématiques de l’Axe 3
Les enzymes, catalyseurs naturels, sont remarquables pour leur efficacité, et leur sélectivité pour effectuer presque sans surtension, et donc dans des conditions proches de l’équilibre thermodynamique, la réduction du CO2 en CO, formiate ou méthanol, la production d’H2 ou d’O2. Elles constituent donc des objets prometteurs en soi pour le développement de procédés biotechnologiques de production de carburants solaires mais également une source d’inspiration pour élaborer ou améliorer les catalyseurs et autres systèmes synthétiques, souvent moins actifs et moins sélectifs.
Ces enzymes sont pour la plupart d’imposants complexes protéiques contenant plusieurs centres actifs (organiques ou à base de métaux de transition), produits et assemblés in vivo grâce à des machineries biologiques spécifiques et particulièrement sophistiquées. Elles peuvent être purifiées à partir des microorganismes qui les produisent et étudiées pour en comprendre les mécanismes catalytiques moléculaires et ainsi inspirer la conception de catalyseurs synthétiques. Connectées à des photosensibilisateurs moléculaires elles peuvent être activées par la lumière et l’utilisation des impulsions laser permet de résoudre cinétiquement la séquence réactionnelle. Il est aussi possible de connecter à des électrodes des enzymes photosynthétiques comme les photosystèmes I ou II, particulièrement efficaces pour la séparation de charge photo-induite, et de les combiner à d’autres enzymes ou des catalyseurs de synthèse (moléculaires ou nano-particulaires) afin de constituer des systèmes photocatalytiques.

Le site actif NiFe de la CO déhydrogénase. pdb 6B6V. 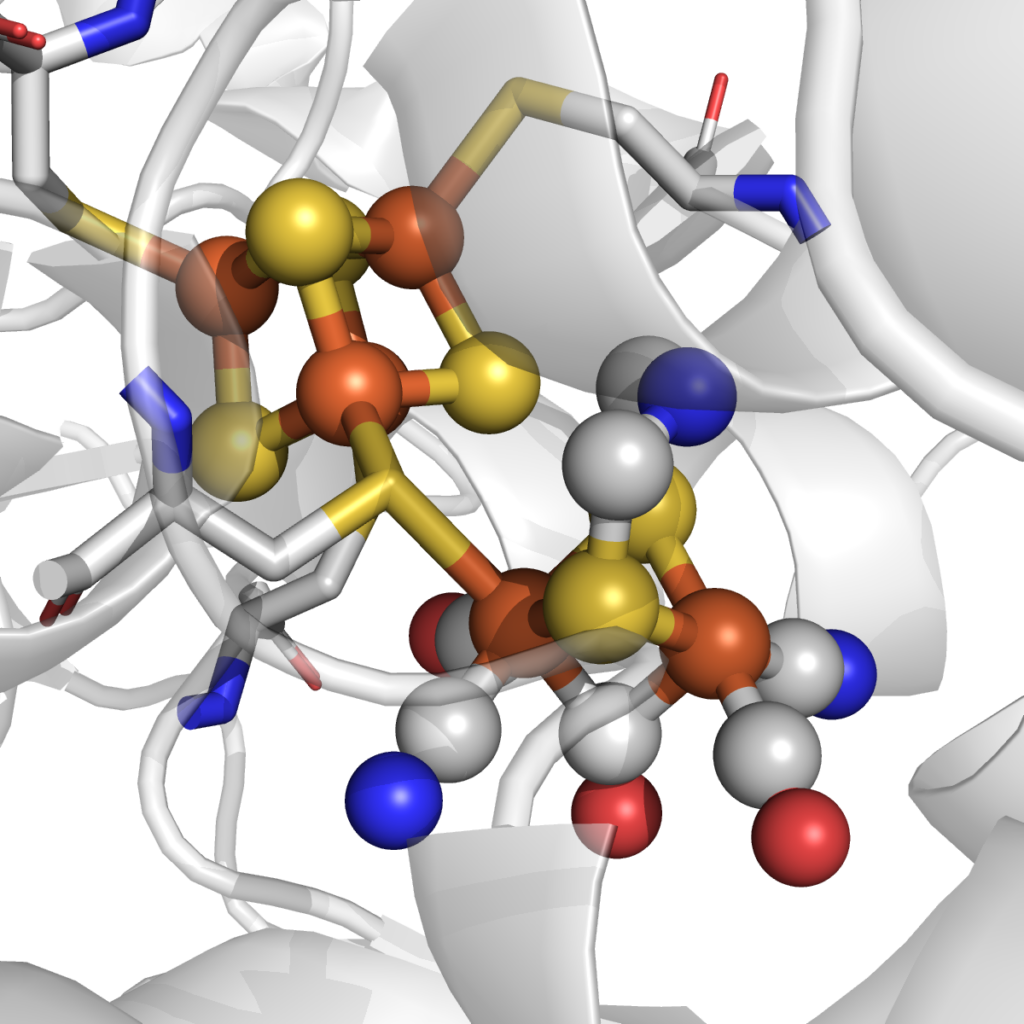
Le site actif de l’hydrogénase FeFe.
pdb 6NAC.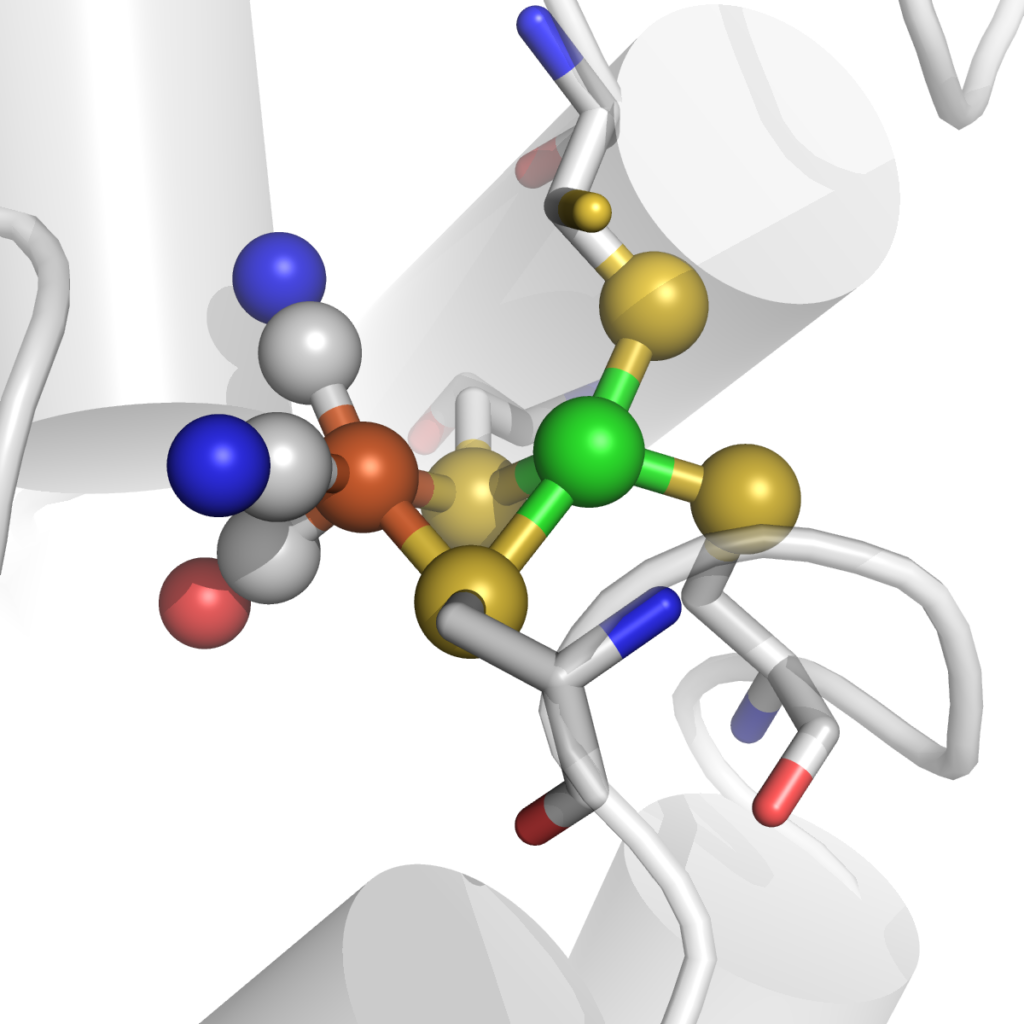
Le site actif de l’hydrogénase NiFe.
pdb 1YWQ.
Le site actif à cuivre (T2/T3) de la laccase. pdb 1GYC. 
Le site actif à tungstène de la formiate déhydrogénase à Mo (ou W). pdb 6sdv. 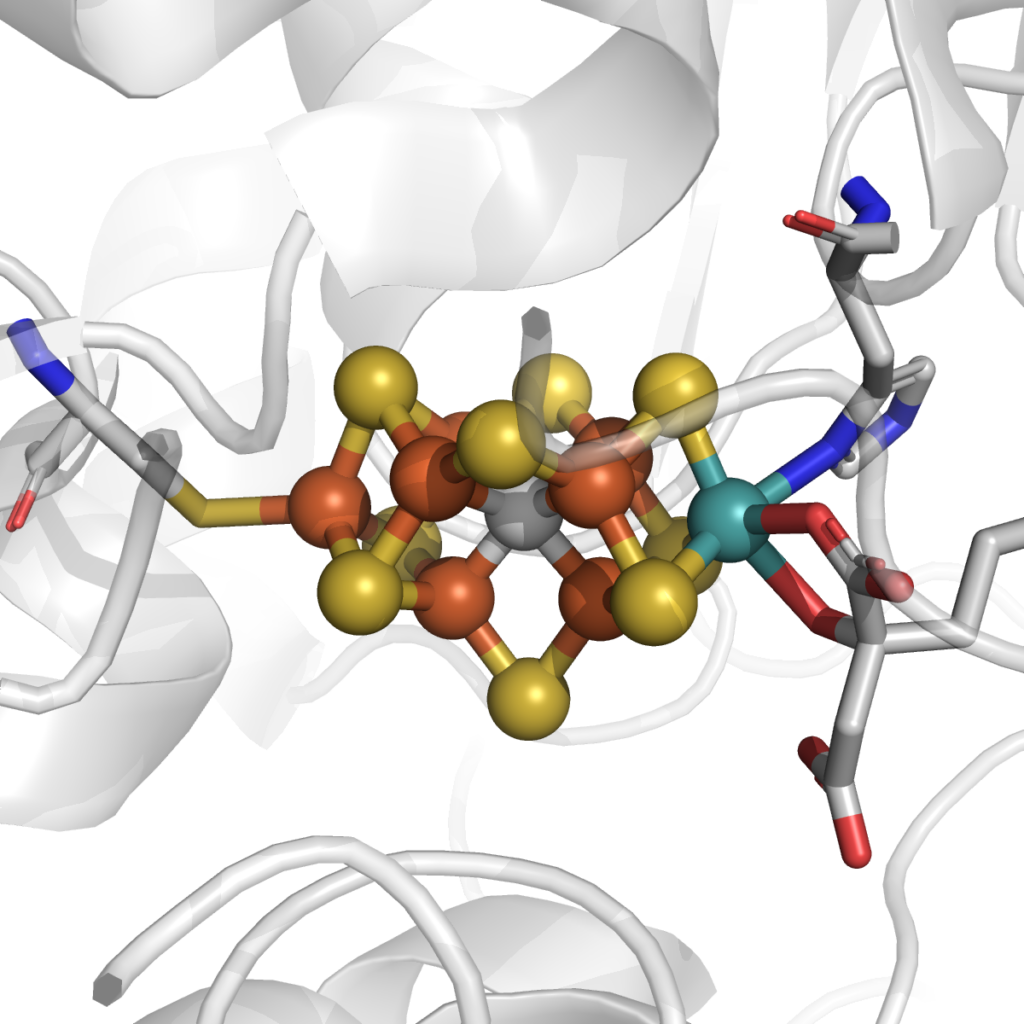
Le site actif Fe/Mo de la nitrogénase.
pdb 6VXT.
Code couleur : fer ou cuivre (orange), nickel (vert), molybdène ou tungstène (turquoise), soufre (jaune), sélénium (orange clair), oxygène (rouge), azote (bleu), carbone (gris clair). Crédits: wikimedia commons CC-BY-SA-4.0
Programme de recherche
Une dizaine d’enzymes sont déjà ou seront étudiées et utilisées dans le cadre du projet. Ces enzymes produisent le dihydrogène (hydrogénases, H2ase), réduisent le CO2 en CO ([NiFe]-CO-déshydrogénase, CODH), le CO2 en pyruvate (pyruvate ferredoxin oxydoreductase, PFOR), le CO2 en formiate (formiate déshydrogénase, FDH), et le formiate en méthanol. Certaines des enzymes d’intérêt dans ce projet ont été sélectionnées pour leurs propriétés (e.g. H2ase résistantes à l’oxygène de E. coli; FDH ayant une activité de réduction du CO2 particulièrement élevée, etc.). L’étude de leur mécanisme par des techniques biophysiques et le développement de procédés qui les utilisent requiert de grandes quantités de matériel biologique dont la production est parfois intrinsèquement limitée par la machinerie cellulaire. Pour cette raison, toutes les enzymes d’intérêt citées plus haut seront étudiées dans certaines équipes du GDR avec l’objectif d’en comprendre et contrôler la production, en termes de qualité et de quantité. Un aspect essentiel aussi concerne la production d’enzymes sélectivement modifiées par mutagenèse dirigée, soit pour introduire des acides aminés qui permettent l’attachement sur un support (électrode, nanoparticule etc.), soit parce que la mutation confère à l’enzyme un avantage en termes de vitesse, directionalité, résistance au stress (oxygène ou autres inhibiteurs, température, conditions rédox extrêmes, éclairement intense…), soit parce que l’étude du mutant permet de mieux comprendre le mécanisme opérationnel dans l’enzyme native. Les équipes partenaires du GDR développeront donc la production des enzymes d’intérêt et de mutants ponctuels de ces enzymes.
Les partenaires « biophysiciens » utiliseront le vaste panel de techniques structurales, spectroscopiques et cinétiques qui est à leur disposition pour caractériser les mécanismes des enzymes d’intérêt. Les questions qui seront abordées concernent par exemple:
– comment la première et deuxième sphères de coordination de l’ion molybdène ou tungstène des formiate déshydrogénases déterminent la spécificité de l’enzyme vis-à-vis de son substrat (l’analyse des séquences ne permet pas de distinguer les FDHs présentant une activité orientée dans un sens ou l’autre de la réaction dont le mécanisme catalytique est très controversé),
– comment les centres rédox distants du site actif dans les hydrogénases de type NiFe contribuent à rendre certaines enzymes plus résistantes à l’O2,
– l’identification des éléments structuraux réellement indispensables à l’activité de réduction du CO2 par les CO-déshydrogénases (CODH), et la conception d’une CODH « minimale », plus simple et peut-être plus robuste,
– la possibilité nouvellement démontrée d’utiliser les laccases pour oxyder l’eau (plutôt que pour réduire le dioxygène), et le mécanisme catalytique de cette oxydation,
– l’importance du couplage entre transfert d’électron et de proton dans les étapes d’activation du cycle catalytique.
L’étude fondamentale de ces mécanismes enzymatiques ou des processus de maturation pourra orienter la conception de catalyseurs synthétiques efficaces: ce transfert de connaissances s’est produit ces dernières années dans le cas des hydrogénases, les enzymes qui réduisent et produisent H2, avec les implications que l’on peut anticiper dans le contexte des bioénergies. Ces informations seront aussi utilisées pour synthétiser des enzymes artificielles selon une approche biosynthétique associant site catalytique de synthèse et protéine hôte qui lui procure un environnement moléculaire contrôlé. Les enzymes pourront aussi être intégrées à des dispositifs « hybrides » en les combinant soit à des systèmes photocatalytiques moléculaires (La laccase qui catalyse la réduction d’oxygène peut alors être utilisée pour substituer le dioxygène aux accepteurs sacrificiels d’électrons); soit en les immobilisant sur des surfaces d’électrodes, de photoélectrodes ou des nanoparticules semi-conductrices.
